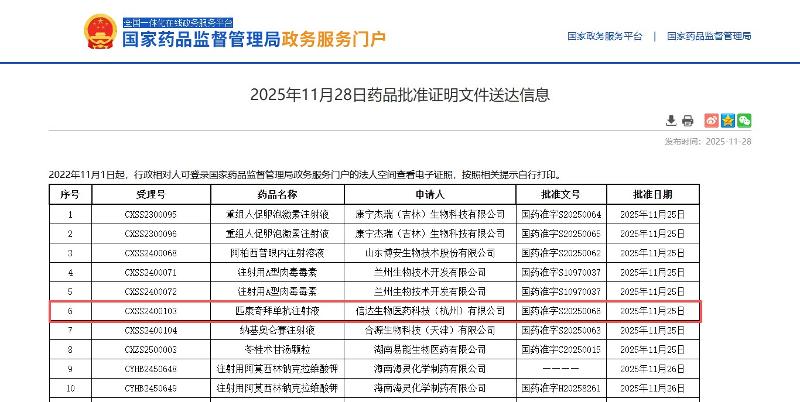
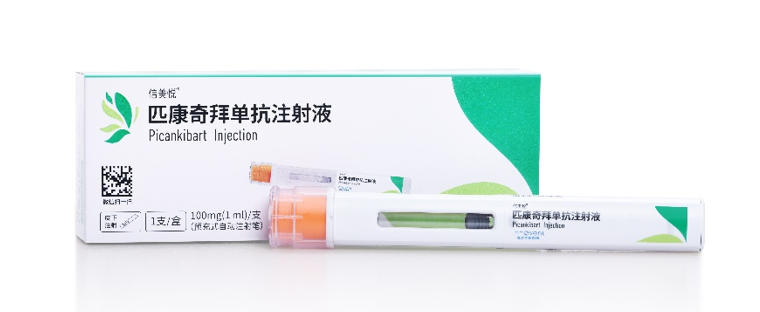
11月28日,信達(dá)生物制藥集團(tuán)(香港聯(lián)交所:01801)宣布,其自主研發(fā)的信美悅?(匹康奇拜單抗注射液)已獲得國家藥品監(jiān)督管理局(NMPA)批準(zhǔn),用于適合系統(tǒng)治療的中重度斑塊狀銀屑病成年患者。
作為中國首個由本土企業(yè)自主研發(fā)的IL-23p19靶點單抗藥物,信美悅?的上市標(biāo)志著國內(nèi)銀屑病精準(zhǔn)治療邁入新的階段。該藥在臨床研究中不僅實現(xiàn)了深度快速的皮損清除,在維持期更可實現(xiàn)“每季度給藥一次”,且仍保持強(qiáng)效療效,為患者長期管理提供新的解決方案。
銀屑病是個體與環(huán)境相互影響誘發(fā)的免疫介導(dǎo)的慢性、復(fù)發(fā)性、炎癥性、系統(tǒng)性疾病,具有反復(fù)發(fā)作和終身管理的特征。患者通常表現(xiàn)為皮膚上的紅斑、鱗屑與斑塊,可能累及頭皮、指甲與掌跖等部位,影響外觀、睡眠、社交與情緒狀態(tài)。
據(jù)估算,中國銀屑病患者超過700萬,斑塊型占多數(shù),其中約三成屬于中重度。盡管目前無法根治,但遴選更有效、適配個體化的治療方案,對于控制病情、降低共病風(fēng)險、維持長期療效,以及全面提升生活質(zhì)量至關(guān)重要。
CLEAR-1的主要研究者、上海市皮膚病醫(yī)院史玉玲教授指出,現(xiàn)有研究證據(jù)提示IL?23p19靶點抗體在長期療效維持及用藥便利性方面具有顯著優(yōu)勢。匹康奇拜單抗作為首個由中國企業(yè)自主研發(fā)的IL?23p19單抗,在臨床研究中展現(xiàn)出卓越的短期療效并實現(xiàn)長期療效的良好維持。
此次獲批的信美悅?基于在中國開展的Ⅲ期研究CLEAR-1。該項研究顯示,信美悅?(匹康奇拜單抗)在第16周達(dá)到PASI90的比例為80.3%,是全球首個注冊Ⅲ期臨床主要研究終點第16周達(dá)到PASI90的受試者比例突破80%的IL-23p19抗體藥物。也就是說臨床試驗中匹康奇拜單抗治療四個月,有超80%的患者皮損能夠清除90%以上。
進(jìn)入維持治療后,匹康奇拜單抗可實現(xiàn)每12周一次的給藥頻率,在減少給藥負(fù)擔(dān)的同時仍能保持長間隔療效維持,并對合并頭皮、隱私部位及高BMI分層人群等也顯示出快速持續(xù)的改善,整體安全性良好。
與現(xiàn)有主流生物制劑多數(shù)需每月或每兩個月注射一次不同,信美悅?通過創(chuàng)新性地對抗體結(jié)構(gòu)進(jìn)行生物工程改造延長了藥物在體內(nèi)的半衰期,在同類生物藥中擁有最長維持給藥間隔,維持期每年僅需給藥4次,為患者帶來更輕負(fù)擔(dān)、更高依從性的長期管理體驗。真正意義上形成了“快速起效、季度給藥、強(qiáng)效維持”的獨特優(yōu)勢。
據(jù)了解,信美悅?是信達(dá)生物的第17款上市產(chǎn)品,也是公司在自身免疫領(lǐng)域的關(guān)鍵產(chǎn)品之一。作為信達(dá)生物四大核心研究領(lǐng)域之一,自身免疫業(yè)務(wù)正成為推動信達(dá)生物持續(xù)增長的重要板塊。信達(dá)生物在此次公告中表示,公司將繼續(xù)推動匹康奇拜單抗在更多銀屑病亞型、銀屑病關(guān)節(jié)炎及青少年銀屑病等領(lǐng)域的研究,以不斷拓展其治療價值,滿足更多患者的臨床需求。
從疾病管理角度看,信美悅?的上市不僅為中國銀屑病患者提供了兼具快速起效、長效維持與便利性的全新治療選擇,也代表著國產(chǎn)創(chuàng)新藥在免疫疾病領(lǐng)域邁出的關(guān)鍵一步。隨著更多創(chuàng)新藥物不斷落地,中國銀屑病治療正向更精準(zhǔn)、更便利、更注重長期穩(wěn)定控制的新階段發(fā)展。
編輯 唐曉雯
2025年11月29日